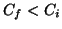Next: Slide n. 61: titolazioni
Up: Slides delle lezioni del
Previous: Slide n. 59: interconversione
- La molarita' e' un'utile unita' di misura in laboratorio: per
preparare una soluzione di data molarita', basta porre in un matraccio
tarato la massa di soluto corrispondente al numero di moli desiderato ed
aggiungere acqua fino a portare il volume della soluzione alla
tacca.
- Tuttavia, la molarita' di una soluzione varia (anche se di poco)
con la temperatura: infatti il volume della soluzione e' maggiore a
temperatura maggiore. Per questo motivo e' stata introdotta la
molalita', che riferendo la quantita' di soluto alla massa di
solvente (espressa in
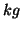 ), non presenta alcuna dipendenza dalla
temperatura.
), non presenta alcuna dipendenza dalla
temperatura.
- Diluizione.
Spesso una soluzione viene aggiunta ad un'altra; oppure solvente puro (acqua)
viene aggiunto ad una soluzione. In entrambi i casi il volume della
soluzione finale e' maggiore di quello della soluzione iniziale: si dice
che la soluzione iniziale e' stata diluita.
- Dalla definizione di concentrazione (ad esempio molarita'), si
vede che una diluizione provoca un cambiamento della concentrazione:
infatti, mentre il numero di moli di soluto non cambia, il
volume cambia. Se
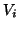 e' il volume iniziale,
e' il volume iniziale, 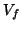 quello finale
ed
quello finale
ed 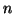 il numero di moli di soluto, allora la relazione fra
concentrazione finale
il numero di moli di soluto, allora la relazione fra
concentrazione finale 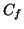 e concentrazione iniziale
e concentrazione iniziale 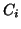 e':
e':
Siccome per una diluizione 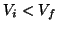 , segue
, segue 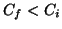




Next: Slide n. 61: titolazioni
Up: Slides delle lezioni del
Previous: Slide n. 59: interconversione
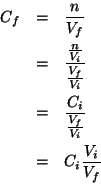
, segue