



Next: Slide n. 428: generatori
Up: Slides delle lezioni del
Previous: Slide n. 426: figura
Elettrolisi.
- Si e' visto che nelle pile la spontaneita' di una reazione
chimica (la reazione redox globale, somma delle due semireazioni che
avvengono in ciascuna semicella) viene sfruttata per produrre una
corrente elettrica utilizzabile.
- Si e' visto che, in pratica, la reazione globale avviene a
causa di un flusso di elettroni che, muovendosi da una semicella
all'altra, squilibrano le due semireazioni elettrodiche spostandole
una nel verso della riduzione (al catodo, potenziale elettrodico
maggiore) e l'altra in quello dell'ossidazione (all'anodo, potenziale
elettrodico minore).
- Questo meccanismo suggerisce la possibilita' di far
avvenire la reazione redox globale nel verso contrario a quello
spontaneo. Bastera' infatti forzare gli elettroni a muoversi
nel verso contrario a quello in cui si muoverebbero spontaneamente: in
tal modo, le due semireazioni verrebbero perturbate in modo contrario
a quello visto per le pile.
- Per comprendere meglio il senso di questa affermazione,
consideriamo nuovamente la cella elettrochimica che avevamo analizzato
in precedenza per illustrare il principio di funzionamento di una
pila.
- Si trattava della cella costituita dall'accoppiamento di una
semicella
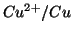 con una semicella
con una semicella
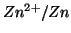 . Supponendo che le concentrazioni di ioni
. Supponendo che le concentrazioni di ioni
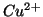 e
e 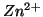 nelle soluzioni delle due semicelle
siano uguali, avevamo visto che il potenziale elettrodico della
semicella
nelle soluzioni delle due semicelle
siano uguali, avevamo visto che il potenziale elettrodico della
semicella 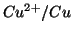 risulta maggiore di quello della semicella
risulta maggiore di quello della semicella
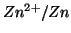 . Da cio' segue che, connettendo il filo di rame e
quello di zinco con un semplice conduttore elettrico, si avrebbe un
flusso di elettroni diretto dallo zinco al rame.
. Da cio' segue che, connettendo il filo di rame e
quello di zinco con un semplice conduttore elettrico, si avrebbe un
flusso di elettroni diretto dallo zinco al rame.




Next: Slide n. 428: generatori
Up: Slides delle lezioni del
Previous: Slide n. 426: figura