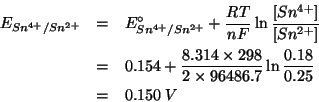Next: Slide n. 426: figura
Up: Slides delle lezioni del
Previous: Slide n. 424: esempio
Per la semicella
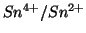 :
:
Come si vede,
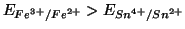 . Cio'
significa, per quanto abbiamo visto in generale, che nella semicella
. Cio'
significa, per quanto abbiamo visto in generale, che nella semicella
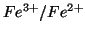 si avra' una riduzione, mentre nella
semicella
si avra' una riduzione, mentre nella
semicella
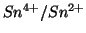 si avra' un'ossidazione; in altre
parole, la semicella
si avra' un'ossidazione; in altre
parole, la semicella
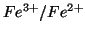 sara' il catodo e la
semicella
sara' il catodo e la
semicella
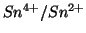 sara' l'anodo. Connettendo i due
fili di
sara' l'anodo. Connettendo i due
fili di  immersi in ciascuna semicella con un conduttore
elettrico si avra' un flusso di elettroni dall'anodo (semicella
immersi in ciascuna semicella con un conduttore
elettrico si avra' un flusso di elettroni dall'anodo (semicella
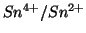 a potenziale elettrodico minore) al catodo
(semicella
a potenziale elettrodico minore) al catodo
(semicella
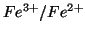 a potenziale elettrodico
maggiore). Quindi, la reazione globale su cui si basa il funzionamento della
pila e':
a potenziale elettrodico
maggiore). Quindi, la reazione globale su cui si basa il funzionamento della
pila e':
La forza elettromotrice della pila, espressa come
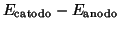 , vale
, vale
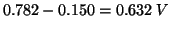 . Quindi, la variazione di energia libera di
Gibbs per la reazione su scritta e':
. Quindi, la variazione di energia libera di
Gibbs per la reazione su scritta e':
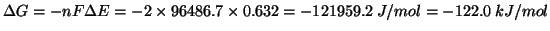 .
.
Sulla base dei potenziali elettrodici che abbiamo calcolato (o basandoci
equivalentemente sul valore di 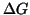 ), possiamo inoltre dire
che se le due soluzioni venissero semplicemente mescolate assieme, si
avrebbe l'ossidazione degli ioni
), possiamo inoltre dire
che se le due soluzioni venissero semplicemente mescolate assieme, si
avrebbe l'ossidazione degli ioni 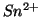 da parte degli ioni
da parte degli ioni
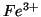 , e non viceversa.
, e non viceversa.




Next: Slide n. 426: figura
Up: Slides delle lezioni del
Previous: Slide n. 424: esempio