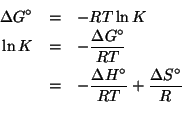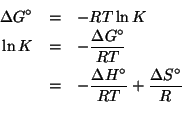Next: Slide n. 389: figura
Up: Slides delle lezioni del
Previous: Slide n. 387:
- Se per certe condizioni iniziali si ha
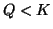 , allora il
termine logaritmico e' negativo e cosi' pure
, allora il
termine logaritmico e' negativo e cosi' pure 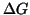 : la
reazione diretta e' spontanea. Viceversa, se il sistema parte con
delle concentrazioni iniziali tali che
: la
reazione diretta e' spontanea. Viceversa, se il sistema parte con
delle concentrazioni iniziali tali che 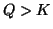 , allora
, allora
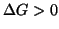 : la reazione diretta non e' spontanea e il sistema si
evolve nella direzione della reazione inversa. Infine, se
: la reazione diretta non e' spontanea e il sistema si
evolve nella direzione della reazione inversa. Infine, se 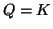 ,
allora
,
allora 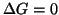 e' il sistema si trova all'equilibrio.
e' il sistema si trova all'equilibrio.
- Dalla relazione
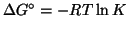 si vede che
si vede che
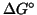 e
e 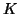 sono due informazioni
perfettamente equivalenti per una certa reazione: entrambe
esprimono quantitativamente la tendenza della reazione ad
avvenire. Una grande costante di equilibrio significa un grande valore
negativo di
sono due informazioni
perfettamente equivalenti per una certa reazione: entrambe
esprimono quantitativamente la tendenza della reazione ad
avvenire. Una grande costante di equilibrio significa un grande valore
negativo di
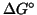 , cioe' una grande tendenza della
reazione ad avvenire spontaneamente.
, cioe' una grande tendenza della
reazione ad avvenire spontaneamente.
- Siccome
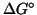 dipende dalla temperatura, la relazione fra
dipende dalla temperatura, la relazione fra
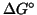 e
e 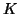 consente di
ricavare la dipendenza della costante di equilibrio dalla temperatura.
consente di
ricavare la dipendenza della costante di equilibrio dalla temperatura.
- Come avevamo gia' visto qualitativamente sulla base del
principio di Le Chatelier, l'influenza della temperatura sulla
costante di equilibrio dipende da
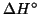 . Se
. Se
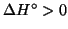 , la pendenza della retta
, la pendenza della retta 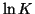 in funzione di
in funzione di
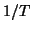 e' negativa, e quindi
e' negativa, e quindi 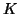 aumenta al diminuire di
aumenta al diminuire di 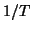 ,
ovvero all'aumentare di
,
ovvero all'aumentare di 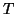 ; il viceversa vale se
; il viceversa vale se
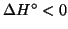 . Cio' e' in perfetto accordo con le conclusioni a
cui eravamo giunti in precedenza sulla base del principio di Le
Chatelier: la costante di equilibrio cresce con la temperatura per
reazioni endotermiche, mentre diminuisce al crescere della temperatura
per reazioni esotermiche.
. Cio' e' in perfetto accordo con le conclusioni a
cui eravamo giunti in precedenza sulla base del principio di Le
Chatelier: la costante di equilibrio cresce con la temperatura per
reazioni endotermiche, mentre diminuisce al crescere della temperatura
per reazioni esotermiche.




Next: Slide n. 389: figura
Up: Slides delle lezioni del
Previous: Slide n. 387: