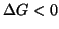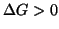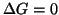Next: Slide n. 384: figura
Up: Slides delle lezioni del
Previous: Slide n. 382: l'energia
- Per quanto appena visto, si puo' determinare la spontaneita'
di un processo isotermo e isobaro sulla base della variazione di energia
libera di Gibbs ad esso associata (e riferita al solo sistema):
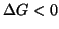
- Il processo e' spontaneo
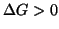
- Il processo non e' spontaneo: il
processo inverso e' spontaneo
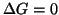
- Il processo diretto e quello inverso
hanno il medesimo grado di spontaneita': nessuno dei due tende ad
avvenire di preferenza rispetto all'altro. Il sistema si trova
in condizioni di equilibrio.
- L'espressione per la variazione di energia libera di Gibbs:
richiede qualche commento. La spontaneita' di un processo chimico
dipende dalla variazione di entalpia e da quella di entropia. Il segno
e/o l'entita' di queste variazioni determinano il segno di
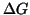 e quindi la spontaneita' del processo. Assumendo, come
si trova generalmente, che
e quindi la spontaneita' del processo. Assumendo, come
si trova generalmente, che 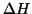 e
e 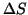 non varino
molto con la temperatura, e' chiaro che, se
non varino
molto con la temperatura, e' chiaro che, se
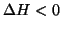 e
e 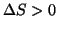 , si avra' sempre
, si avra' sempre 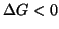 e
il processo sara' sempre spontaneo (termodinamicamente favorito);
all'opposto, se
e
il processo sara' sempre spontaneo (termodinamicamente favorito);
all'opposto, se 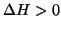 e
e 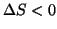 , si avra' sempre
, si avra' sempre
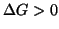 e il processo risultera' sempre termodinamicamente
sfavorito. Se la variazione entalpica e quella entropica hanno lo
stesso segno, la spontaneita' del processo dipende dalla
temperatura. Ad esempio, se
e il processo risultera' sempre termodinamicamente
sfavorito. Se la variazione entalpica e quella entropica hanno lo
stesso segno, la spontaneita' del processo dipende dalla
temperatura. Ad esempio, se 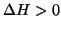 e
e 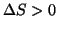 , il
processo sara' spontaneo ad alta temperatura e non spontaneo a bassa
temperatura. Il viceversa vale se
, il
processo sara' spontaneo ad alta temperatura e non spontaneo a bassa
temperatura. Il viceversa vale se 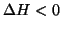 e
e 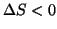 .
.




Next: Slide n. 384: figura
Up: Slides delle lezioni del
Previous: Slide n. 382: l'energia