



Next: Slide n. 381: il
Up: Slides delle lezioni del
Previous: Slide n. 379: entropie
- Abbiamo visto che la variazione di entalpia per una reazione non
e' in grado di dirci se tale reazione e' spontanea o meno. Abbiamo
anche visto che molti processi sembrano essere spinti dal
raggiungimento di uno stato di massimo disordine. Tali processi sono
caratterizzati da
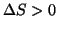 .
.
- Questa condizione, tuttavia, similmente alla condizione sulla
diminuzione di energia,
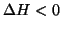 , non ha validita' generale. Si
possono infatti trovare moltissimi esempi di processi spontanei, ma
con
, non ha validita' generale. Si
possono infatti trovare moltissimi esempi di processi spontanei, ma
con 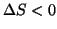 . Tutti i processi di solidificazione e
condensazione sono caratterizzati da una variazione negativa di
entropia, eppure, la solidificazione dell'acqua a
. Tutti i processi di solidificazione e
condensazione sono caratterizzati da una variazione negativa di
entropia, eppure, la solidificazione dell'acqua a 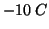 e' un
processo spontaneo.
e' un
processo spontaneo.
- In realta', la variazione di entropia per un processo puo'
rappresentare effettivamente un criterio generale di spontaneita',
a condizione che tale variazione comprenda quella del sistema
e quella del resto dell'universo.
- Cio' rappresenta la sostanza del secondo principio della
termodinamica:
Per un qualsiasi processo spontaneo, la variazione di
entropia dell'universo (cioe' sistema piu' ambiente circostante) e' positiva.
- Dato che tutti i processi naturali sono spontanei,
un'enunciazione equivalente del secondo principio e' che l'entropia
dell'universo e' in continuo aumento.




Next: Slide n. 381: il
Up: Slides delle lezioni del
Previous: Slide n. 379: entropie