



Next: Slide n. 379: entropie
Up: Slides delle lezioni del
Previous: Slide n. 377: variazione
- La definizione che si e' data per la variazione di entropia
relativa ad un processo reversibile vale a temperatura costante. Ma
come varia l'entropia con la temperatura? Intuitivamente, al diminuire
della temperatura l'energia cinetica delle molecole diminuisce e
quindi il loro moto diventa meno caotico. Basandoci
sull'identificazione dell'entropia con il grado di disordine, possiamo
quindi dire che l'entropia di una sostanza deve diminuire al diminuire
della temperatura.
- Cio' trova una espressione formale nel terzo principio
della termodinamica, secondo cui l'entropia di una sostanza pura in
uno stato cristallino a
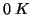 e' nulla.
e' nulla.
- Il terzo principio consente di determinare l'entropia assoluta
di una sostanza a una certa temperatura, determinando sperimentalmente
la variazione di entropia subita dalla sostanza nel processo di
riscaldamento a partire da
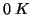 .
.
- Esistono tabelle molto estese che
riportano l'entropia molare standard di moltissime sostanze a
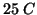 . Come gia' detto parlando dell'entalpia, lo stato standard
di una sostanza corrisponde alla sostanza pura alla pressione di
. Come gia' detto parlando dell'entalpia, lo stato standard
di una sostanza corrisponde alla sostanza pura alla pressione di
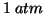 e ad una temperatura prefissata. L'aggettivo ``molare''
indica ovviamente che l'entropia si riferisce ad
e ad una temperatura prefissata. L'aggettivo ``molare''
indica ovviamente che l'entropia si riferisce ad 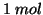 di sostanza
di sostanza
- Sulla base di queste tabelle, e' possibile calcolare
immediatamente la variazione standard di entropia per una qualsiasi reazione a
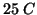 . Per la generica reazione:
. Per la generica reazione:
si avra':




Next: Slide n. 379: entropie
Up: Slides delle lezioni del
Previous: Slide n. 377: variazione