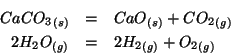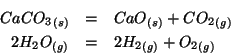Next: Slide n. 375: processi
Up: Slides delle lezioni del
Previous: Slide n. 373: lo
- Il grado di disordine di un sistema e' espresso
quantitativamente da una funzione di stato detta
entropia. Nell'espansione libera vista prima, si ha un
aumento di entropia:
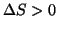 , perche', occupando un volume
maggiore, le molecole del gas sono piu' difficilmente localizzabili e
quindi il sistema e' piu' disordinato.
, perche', occupando un volume
maggiore, le molecole del gas sono piu' difficilmente localizzabili e
quindi il sistema e' piu' disordinato.
- In molti processi il segno della variazione di entropia e'
facilmente intuibile. Ad esempio, nella fusione si ha il passaggio
dallo stato solido, caratterizzato da un ordine a lungo raggio, a quello
liquido, in cui le possibilita' di movimento delle molecole sono molto
maggiori: e' chiaro che in una simile trasformazione si avra' una
variazione positiva di entropia. E' chiaro inoltre (anche per il fatto che
l'entropia e' una funzione di stato) che la variazione di entropia per
il processo inverso (solidificazione) deve essere negativa.
- Altri processi per cui il segno della variazione entropica e'
facilmente prevedibile sono la evaporazione e la sublimazione.
- La variazione di entropia per alcune reazioni chimiche e' di
nuovo facilmente prevedibile. Ad esempio, in tutte le reazioni in cui si
ha formazione di gas da solidi o liquidi, oppure nelle reazioni in fase
gassosa in cui si ha un aumento del numero di molecole si ha anche un
aumento di entropia:




Next: Slide n. 375: processi
Up: Slides delle lezioni del
Previous: Slide n. 373: lo