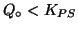Next: Slide n. 363: esempio
Up: Slides delle lezioni del
Previous: Slide n. 361: gli
- La direzione in cui si muove un equilibrio di solubilita' a
partire da una certa condizione iniziale si discute, come abbiamo gia'
visto in generale, sulla base del quoziente di reazione.
- Se poniamo un sale poco solubile in acqua pura, le
concentrazioni iniziali degli ioni in soluzione sono nulle e quindi il
quoziente di reazione vale zero: il solido si sciogliera' producendo
ioni fino a che il quoziente di reazione passa da
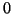 al valore di
al valore di
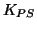 . Il sistema raggiunge cosi' l'equilibrio e la soluzione e'
satura.
. Il sistema raggiunge cosi' l'equilibrio e la soluzione e'
satura.
- Se la quantita' di solido posto in acqua non e' sufficiente a
produrre le concentrazioni ioniche prescritte dalla legge dell'azione
di massa, il quoziente di reazione non riesce a crescere fino al
valore dovuto e il sistema non raggiunge l'equilibrio perche' il
solido viene completamente consumato. La soluzione si dice insatura e
la legge dell'azione di massa non vale.
- Se invece di porre il sale poco solubile in acqua, partiamo dai
suoi ioni (ad esempio mescolando due soluzioni ciascuna contenente uno
ione costituente il sale poco solubile), bisogna valutare il quoziente
di reazione iniziale,
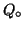 .
.
-
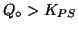
- La soluzione e' soprasatura. Il
quoziente di reazione e' troppo grande: precipitera' un po' di solido
facendo diminuire le concentrazioni ioniche fino a che si arriva
all'equilibrio (
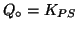 ).
).
-
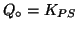
- La soluzione e' satura. Il sistema e' gia'
all'equilibrio.
-
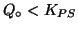
- La soluzione e' insatura. Il sistema non e'
all'equilibrio e il quoziente di reazione e' troppo piccolo. Tuttavia,
siccome non c'e' solido indisciolto che possa aumentare le
concentrazioni ioniche, il sistema non ha modo di raggiungere
l'equilibrio e la legge dell'azione di massa non e' applicabile.




Next: Slide n. 363: esempio
Up: Slides delle lezioni del
Previous: Slide n. 361: gli
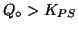
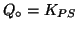 ).
).