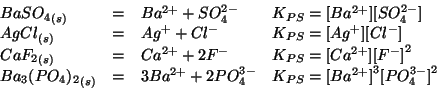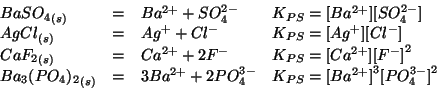Next: Slide n. 361: gli
Up: Slides delle lezioni del
Previous: Slide n. 359: idrolisi
Equilibri di solubilita'.
- Abbiamo visto che alcuni sali sono poco solubili. Abbiamo anche
detto che la solubilita' non va confusa con la dissociazione; quasi
tutti i sali sono degli elettroliti forti, per cui anche i sali poco
solubili sono completamente dissociati
- Allora, l'equazione chimica che descrive la solubilizzazione di
un sale, ad esempio
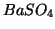 , puo' essere scritta nella forma:
, puo' essere scritta nella forma:
- Anche per l'equilibrio di solubilita' vale la legge dell'azione di
massa nella sua forma usuale. La costante di equilibrio prende il nome
di prodotto di solubilita' e viene spesso indicata col simbolo
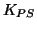 . Esempi:
. Esempi:
- Come gia' detto in precedenza, la concentrazione del solido puro
e' costante ed e' inclusa nel valore di
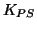 .
.
- La legge dell'azione di massa vale solo quando un processo chimico
si trova in condizioni di equilibrio: abbiamo gia' visto che la
dissoluzione di un soluto in un solvente raggiunge l'equilibrio quando
la velocita' di dissoluzione viene uguagliata da quella di
riaggregazione. In tali condizioni, la quantita' di soluto disciolto e'
massima e la soluzione si dice satura. Se ne conclude che l'espressione
del prodotto di solubilita' e' valida solo in condizioni di
saturazione.
- Ricordiamo che una condizione sufficiente per poter dire che una
soluzione e' satura e' che sia presente del soluto indisciolto (il
cosiddetto corpo di fondo).




Next: Slide n. 361: gli
Up: Slides delle lezioni del
Previous: Slide n. 359: idrolisi