



Next: Slide n. 356: segue
Up: Slides delle lezioni del
Previous: Slide n. 354: proprieta'
- Idrossidi e ossiacidi.
In molte specie con caratteristiche acido
base si trova un gruppo 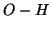 legato ad un altro atomo
legato ad un altro atomo 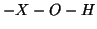 :
esempi di questo tipo sono tutti gli idrossidi e gli ossiacidi. Il
fatto che una specie contenente il gruppo
:
esempi di questo tipo sono tutti gli idrossidi e gli ossiacidi. Il
fatto che una specie contenente il gruppo 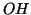 si comporti da base
(come
si comporti da base
(come 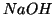 ), da acido (come
), da acido (come 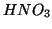 ) o mostri scarsissime
proprieta' acido base (come
) o mostri scarsissime
proprieta' acido base (come 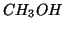 ), e' riconducibile alla
polarizzazione del legame
), e' riconducibile alla
polarizzazione del legame 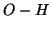 e di quello
e di quello 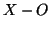 .
.
- Negli idrossidi, si ha un legame metallo ossigeno. I metalli hanno
scarsa elettronegativita' per cui il legame metallo ossigeno e' molto
polarizzato verso l'ossigeno: cio' fa si' che da un lato l'ossigeno sia
ricco di carica negativa e quindi il legame
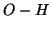 sia poco polarizzato
verso l'ossigeno, e dall'altro che il legame metallo ossigeno possa
essere rotto eteroliticamente per liberare lo ione ossidrile.
sia poco polarizzato
verso l'ossigeno, e dall'altro che il legame metallo ossigeno possa
essere rotto eteroliticamente per liberare lo ione ossidrile.
- Quando l'atomo
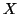 legato all'ossigeno ha
un'elettronegativita' intermedia, il legame con l'ossigeno ha una
forte caratteristica covalente e questo fa si' che la specie non
dissoci ioni ossidrile. Piuttosto, il legame
legato all'ossigeno ha
un'elettronegativita' intermedia, il legame con l'ossigeno ha una
forte caratteristica covalente e questo fa si' che la specie non
dissoci ioni ossidrile. Piuttosto, il legame 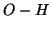 puo' spezzarsi
liberando un protone e determinando cosi' delle proprieta' acide. Ad
esempio,
puo' spezzarsi
liberando un protone e determinando cosi' delle proprieta' acide. Ad
esempio, 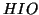 e' un acido piuttosto debole
(
e' un acido piuttosto debole
(
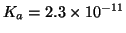 ) e
) e 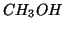 non mostra caratteristiche
acido base.
non mostra caratteristiche
acido base.
- Quando l'atomo
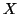 legato all'ossigeno ha una buona
elettronegativita', impoverisce di carica elettronica l'atomo di
ossigeno, rendendo di conseguenza il legame
legato all'ossigeno ha una buona
elettronegativita', impoverisce di carica elettronica l'atomo di
ossigeno, rendendo di conseguenza il legame 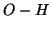 piu' polarizzato. Si
ha in questi casi un comportamento acido (rottura eterolitica del legame
piu' polarizzato. Si
ha in questi casi un comportamento acido (rottura eterolitica del legame
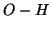 ) che aumenta all'aumentare dell'elettronegativita' di
) che aumenta all'aumentare dell'elettronegativita' di 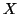 . Un
esempio di questo tipo e' l'andamento della costante di ionizzazione
acida degli acidi ipoalogenosi, che diminuisce nella sequenza
. Un
esempio di questo tipo e' l'andamento della costante di ionizzazione
acida degli acidi ipoalogenosi, che diminuisce nella sequenza 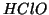 ,
,
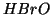 e
e 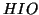 .
.




Next: Slide n. 356: segue
Up: Slides delle lezioni del
Previous: Slide n. 354: proprieta'