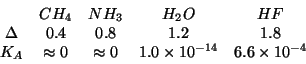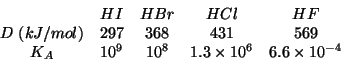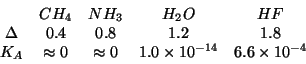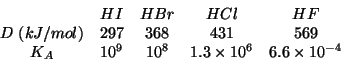Next: Slide n. 355: idrossido
Up: Slides delle lezioni del
Previous: Slide n. 353: figura
Relazione fra proprieta' acido base e struttura chimica.
- I fattori che determinano le proprieta' acido base di una certa
specie chimica sono molteplici e non esistono criteri generali e
infallibili. Si possono tuttavia evidenziare alcuni punti importanti che
valgono in un gran numero di casi semplici.
- Un acido di Lowry e Brönsted e' una specie capace di donare un
protone. Se il protone e' legato all'atomo
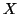 , si deve avere la
rottura eterolitica (cioe' con la perdita dell'elettrone da
parte dell'atomo di idrogeno) del legame
, si deve avere la
rottura eterolitica (cioe' con la perdita dell'elettrone da
parte dell'atomo di idrogeno) del legame
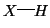 :
:
- E' intuitivo che tale rottura sara' tanto piu' facile quanto
piu' il legame
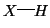 e' polarizzato
verso
e' polarizzato
verso 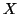 , cioe' quanto piu' elettronegativo e' l'atomo
, cioe' quanto piu' elettronegativo e' l'atomo 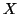 rispetto all'idrogeno. Un esempio di questo effetto e' dato dal
confronto delle proprieta' acide e della differenza di
elettronegativita' nella serie seguente (con
rispetto all'idrogeno. Un esempio di questo effetto e' dato dal
confronto delle proprieta' acide e della differenza di
elettronegativita' nella serie seguente (con 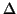 e' indicata la
differenza di elettronegativita' fra il non metallo e l'idrogeno):
e' indicata la
differenza di elettronegativita' fra il non metallo e l'idrogeno):
- L'elettronegativita' non e' pero' l'unico fattore che determina
le proprieta' acide di una specie chimica. Anche l'energia del legame
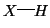 e' importante. Chiaramente,
maggiore e' l'energia richiesta per spezzare il legame
e' importante. Chiaramente,
maggiore e' l'energia richiesta per spezzare il legame
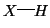 e piu' difficilmente il protone
potra' essere ceduto. Un esempio in questo senso e' dato dalla serie
degli alogenuri di idrogeno. Sulla sola base dell'elettronegativita'
vista sopra, ci si aspetterebbe che
e piu' difficilmente il protone
potra' essere ceduto. Un esempio in questo senso e' dato dalla serie
degli alogenuri di idrogeno. Sulla sola base dell'elettronegativita'
vista sopra, ci si aspetterebbe che 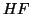 sia l'acido piu'
forte. Invece si osserva una correlazione fra l'energia di
dissociazione (
sia l'acido piu'
forte. Invece si osserva una correlazione fra l'energia di
dissociazione (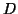 ) e la forza acida:
) e la forza acida:




Next: Slide n. 355: idrossido
Up: Slides delle lezioni del
Previous: Slide n. 353: figura