



Next: Slide n. 348: curva
Up: Slides delle lezioni del
Previous: Slide n. 346: segue
- In alternativa: siccome lo stato di equilibrio che un sistema raggiunge non
dipende dalla direzione seguita per raggiungerlo, idealmente si puo'
neutralizzare prima tutto l'acido acetico, e poi considerare
l'idrolisi dello ione acetato cosi' formato. Anche in questo modo si
conclude che il
 al punto di equivalenza sara' basico (
al punto di equivalenza sara' basico (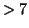 ).
).
- Oltre il punto di equivalenza, le moli di ioni ossidrile aggiunte
sono in eccesso rispetto a quelle di acido acetico inizialmente presenti:
la reazione di neutralizzazione si puo' assumere nuovamente completa e
la concentrazione di ioni ossidrile e' facilmente calcolabile:
Chiaramente, la concentrazione di ioni idronio e il  si ottengono
grazie alla relazione:
si ottengono
grazie alla relazione:
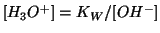 .
.
- L'andamento della curva di titolazione che si puo' calcolare con
le espressioni trovate per il caso della titolazione acido debole/base
forte e' simile a quello gia' visto per il caso acido forte/base forte,
ma il salto di
 che si ha in corrispondenza al punto di
equivalenza e' minore (perche', a parita' di concentrazione, l'acido
debole e' meno ionizzato dell'acido forte e quindi il
che si ha in corrispondenza al punto di
equivalenza e' minore (perche', a parita' di concentrazione, l'acido
debole e' meno ionizzato dell'acido forte e quindi il  di
partenza e' maggiore). Inoltre, il
di
partenza e' maggiore). Inoltre, il  al punto di equivalenza e'
basico (
al punto di equivalenza e'
basico (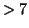 ) a causa del fatto che la costante di equilibrio per la
reazione di neutralizzazione e' minore di
) a causa del fatto che la costante di equilibrio per la
reazione di neutralizzazione e' minore di
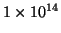 .
.




Next: Slide n. 348: curva
Up: Slides delle lezioni del
Previous: Slide n. 346: segue

