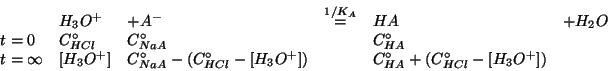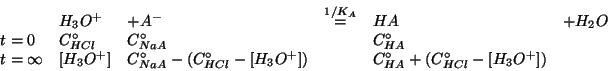Next: Slide n. 330: segue
Up: Slides delle lezioni del
Previous: Slide n. 328: il
- Per una descrizione quantitativa, consideriamo una soluzione
tampone contenente una concentrazione iniziale
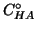 di
acido debole e una concentrazione iniziale
di
acido debole e una concentrazione iniziale 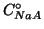 del suo
sale sodico. A questa soluzione aggiungiamo una concentrazione
del suo
sale sodico. A questa soluzione aggiungiamo una concentrazione
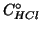 di
di 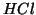 , con
, con 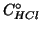 piccola rispetto a
piccola rispetto a
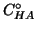 e
e 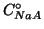 . Ci proponiamo di trovare la
variazione di
. Ci proponiamo di trovare la
variazione di  prodotta dall'aggiunta di
prodotta dall'aggiunta di 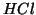 alla soluzione
tampone e confrontarla con la variazione di
alla soluzione
tampone e confrontarla con la variazione di  che la stessa
aggiunta avrebbe provocato in acqua pura.
che la stessa
aggiunta avrebbe provocato in acqua pura.
- Il calcolo della variazione di
 relativa all'acqua pura e'
molto semplice: il
relativa all'acqua pura e'
molto semplice: il  dell'acqua pura e'
dell'acqua pura e' 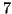 . Il
. Il  dopo
l'aggiunta di una concentrazione
dopo
l'aggiunta di una concentrazione 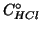 e'
e'
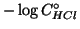 . Quindi la variazione e'
. Quindi la variazione e'
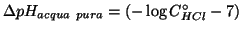 .
.
- Per quanto riguarda la soluzione tampone, il calcolo del
 prima dell'aggiunta dell'acido forte e' stato illustrato prima.
prima dell'aggiunta dell'acido forte e' stato illustrato prima.
- Per il calcolo del
 dopo l'aggiunta dell'acido forte,
bisogna osservare che la soluzione tampone si trova gia' in condizioni
di equilibrio e quindi le concentrazioni di acido debole e della sua
base coniugata non sono uguali ai loro valori iniziali, tuttavia,
siccome lo stato di equilibrio che un sistema raggiunge non
dipende dalla direzione seguita per raggiungerlo, possiamo descrivere
il raggiungimento del nuovo stato di equilibrio partendo da una
concentrazione iniziale di acido debole pari a
dopo l'aggiunta dell'acido forte,
bisogna osservare che la soluzione tampone si trova gia' in condizioni
di equilibrio e quindi le concentrazioni di acido debole e della sua
base coniugata non sono uguali ai loro valori iniziali, tuttavia,
siccome lo stato di equilibrio che un sistema raggiunge non
dipende dalla direzione seguita per raggiungerlo, possiamo descrivere
il raggiungimento del nuovo stato di equilibrio partendo da una
concentrazione iniziale di acido debole pari a 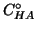 , una
concentrazione iniziale di base coniugata pari a
, una
concentrazione iniziale di base coniugata pari a 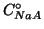 e
una concentrazione iniziale di ioni idronio pari a
e
una concentrazione iniziale di ioni idronio pari a 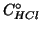 .
.
- Il trattamento del problema e' identico a quello visto per la
soluzione tampone in assenza di acido, salvo che ora la concentrazione
iniziale di ioni idronio non e' nulla e la reazione procede in verso
opposto, come detto piu' sopra:




Next: Slide n. 330: segue
Up: Slides delle lezioni del
Previous: Slide n. 328: il