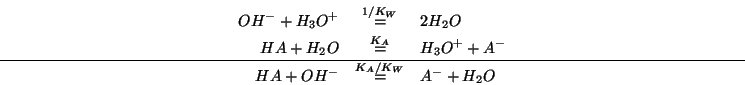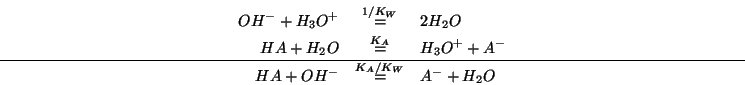Next: Slide n. 329: il
Up: Slides delle lezioni del
Previous: Slide n. 327: il
- Supponiamo ora di aggiungere alla soluzione tampone una piccola
quantita' di base forte. In questo caso, si formera' una
concentrazione stechiometrica di ioni ossidrile. Questi andranno a
reagire con gli ioni idronio in soluzione per formare acqua:
La costante di equilibrio per questa reazione e' l'inverso di 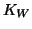 ,
cioe'
,
cioe'
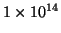 .
.
- Il consumo di ioni idronio (dovuto alla base forte) produrra' a
sua volta uno spostamento dell'equilibrio di ionizzazione dell'acido
debole verso destra, per il principio di Le Chatelier:
- L'effetto globale e' dato dalla somma delle due reazioni su
scritte:
Si vede che, anche se 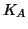 e' piccola, la costante di equilibrio
per la reazione globale e' molto grande a causa di
e' piccola, la costante di equilibrio
per la reazione globale e' molto grande a causa di 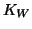 al
denominatore. Cio' significa che la reazione si puo' considerare
completa e quindi tutti gli ioni ossidrile prodotti dall'aggiunta
della base forte vengono consumati. Di conseguenza, si avra' anche in
questo caso una variazione di
al
denominatore. Cio' significa che la reazione si puo' considerare
completa e quindi tutti gli ioni ossidrile prodotti dall'aggiunta
della base forte vengono consumati. Di conseguenza, si avra' anche in
questo caso una variazione di  molto piccola.
molto piccola.
- Di nuovo, va osservato che e' essenziale una concentrazione
apprezzabile di acido debole, in modo che esso non diventi il reagente
limitante per la reazione di consumo degli ioni ossidrile.




Next: Slide n. 329: il
Up: Slides delle lezioni del
Previous: Slide n. 327: il