Riprendiamo la legge dell'azione di massa:
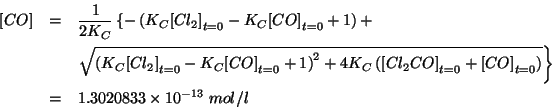 |
(La soluzione che si otterrebbe prendendo il radicale col segno negativo va scartata perche' porterebbe ad una concentrazione negativa)
Come si vede, il risultato e' identico entro le cifre riportate, dimostrando che l'approssimazione adottata e' soddisfacente.
NOTA: per ottenere il valore corretto dalla soluzione
dell'equazione di secondo grado, si devono fare i calcoli con una
elevata precisione (ad esempio 30 cifre significative): una precisione
insufficiente porta a un risultato che puo' essere molto diverso. Ad
esempio, se lo stesso calcolo si esegue con una precisione di solo 12
cifre significative (che e' una precisione confrontabile con quella
di una normale calcolatrice tascabile), il risultato che si ottiene e'
![]() .
.