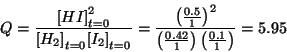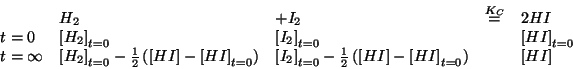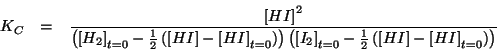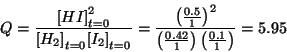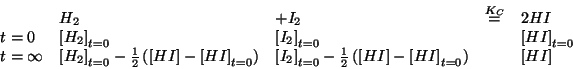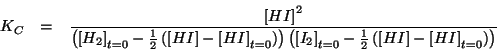Next: Slide n. 284: osservazioni
Up: Slides delle lezioni del
Previous: Slide n. 282: osservazioni
- Una complicazione dell'esempio precedente potrebbe essere quella
in cui le concentrazioni iniziali di tutti i partecipanti alla
reazione sono non nulle. Supponiamo che nel recipiente del volume di
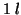 vengano poste
vengano poste 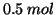 di
di 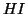 ,
, 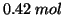 di
di
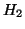 e
e 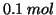 di
di 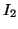 alla temperatura di
alla temperatura di
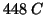 . Quali saranno le concentrazioni dei tre partecipanti alla
reazione quando il sistema raggiunge l'equilibrio?
. Quali saranno le concentrazioni dei tre partecipanti alla
reazione quando il sistema raggiunge l'equilibrio?
- In questo caso, prima di costruire la tabella che descrive il
sistema reagente, bisogna appurare in quale verso procedera' la
reazione. A questo scopo si deve calcolare il quoziente di reazione
relativo alle concentrazioni iniziali:
- Siccome
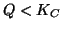 , il sistema si muovera' nella direzione in cui
, il sistema si muovera' nella direzione in cui
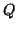 aumenta fino a raggiungere il valore di equilibrio (
aumenta fino a raggiungere il valore di equilibrio (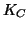 ). Il
modo per far aumentare
). Il
modo per far aumentare 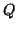 e' quello di consumare reagenti e
produrre prodotti: quindi, date le condizioni iniziali del problema,
la reazione procedera' nel verso di formazione di
e' quello di consumare reagenti e
produrre prodotti: quindi, date le condizioni iniziali del problema,
la reazione procedera' nel verso di formazione di 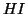 .
.
- A questo punto si puo' costruire la tabella utile per trattare
il problema. Come gia' visto, la scelta dell'incognita e'
completamente arbitraria: ad esempio, poniamo come incognita la
concentrazione di
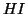 all'equilibrio:
all'equilibrio:
- Infine, le concentrazioni di equilibrio (espresse in funzione di
una sola di esse), vengono inserite nella legge dell'azione di massa,
che viene poi risolta rispetto all'unica incognita:




Next: Slide n. 284: osservazioni
Up: Slides delle lezioni del
Previous: Slide n. 282: osservazioni