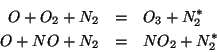Next: Slide n. 251: ordine
Up: Slides delle lezioni del
Previous: Slide n. 249: meccanismo
- Si definisce molecolarita' di uno stadio elementare il
numero di molecole che vi partecipano come reagenti.
Ad esempio, la
reazione di isomerizzazione dell'isocianuro di metile avviene in un
unico stadio elementare di molecolarita' pari a 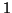 ; la reazione di
formazione di
; la reazione di
formazione di 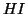 consiste in un unico stadio elementare di
molecolarita' pari a
consiste in un unico stadio elementare di
molecolarita' pari a 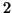 . La maggior parte degli stadi elementari
trimolecolari conosciuti comporta la combinazione di due specie
assistita da una terza il cui ruolo e' rimuovere l'eccesso di energia
prodotta dalla formazione di un legame chimico. Ad esempio:
. La maggior parte degli stadi elementari
trimolecolari conosciuti comporta la combinazione di due specie
assistita da una terza il cui ruolo e' rimuovere l'eccesso di energia
prodotta dalla formazione di un legame chimico. Ad esempio:
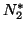 rappresenta una molecola di azoto promossa ad uno stato
eccitato dall'assorbimento dell'energia liberata in seguito alla
formazione di
rappresenta una molecola di azoto promossa ad uno stato
eccitato dall'assorbimento dell'energia liberata in seguito alla
formazione di 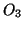 o
o 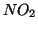 .
.
- Per evidenti motivi di probabilita', non sono noti processi
elementari di molecolarita' superiore a
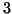 .
.
- Si e' detto in precedenza che l'ordine di reazione rispetto ad
un reagente non ha alcuna relazione con il suo coefficiente
stechiometrico nella reazione globale. Questo e' vero in generale per
una legge cinetica qualsiasi: infatti, come vedremo piu' in dettaglio,
la legge cinetica e' il risultato della combinazione delle velocita'
di tutti gli stadi elementari che costituiscono il meccanismo della
reazione globale.
- Tuttavia, per un singolo stadio elementare, la situazione
risulta semplificata. Consideriamo uno stadio elementare bimolecolare:
Siccome questo processo avviene tramite un singolo urto fra i
reagenti, la probabilita' che essi si incontrino (e quindi la
velocita' dello stadio elementare) deve essere proporzionale alle loro
concentrazioni. Ne segue:




Next: Slide n. 251: ordine
Up: Slides delle lezioni del
Previous: Slide n. 249: meccanismo