



Next: Slide n. 245: figura
Up: Slides delle lezioni del
Previous: Slide n. 243: integrazione
- Si e' visto che la dipendenza della velocita' di reazione dalla
temperatura e' contenuta nella costante cinetica
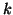 . Prima di
vedere come
. Prima di
vedere come 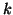 dipende dalla temperatura, introduciamo qualche
concetto elementare riguardante l'interpretazione microscopica delle
reazioni chimiche.
dipende dalla temperatura, introduciamo qualche
concetto elementare riguardante l'interpretazione microscopica delle
reazioni chimiche.
- Consideriamo la reazione di isomerizzazione dell'isocianuro di
metile ad acetonitrile:
Questa reazione e' esotermica, cioe' 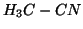 e' piu' stabile di
e' piu' stabile di
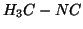 .
.
- Tuttavia, per trasformarsi in acetonitrile, l'isocianuro di
metile deve attraversare stati di energia piu' elevata, in cui il
legame
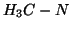 si spezza e il gruppo
si spezza e il gruppo 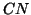 si orienta dalla parte
opposta.
si orienta dalla parte
opposta.
- Il processo si puo' rappresentare con un profilo di
reazione: un diagramma in cui si riporta l'energia del sistema
reagente in funzione di un'opportuna coordinata di reazione,
cioe' una grandezza indicativa del grado di avanzamento del processo
di isomerizzazione. Nel caso specifico, la coordinata di reazione
potrebbe essere la distanza
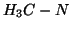 : tale distanza varia dal valore
del legame
: tale distanza varia dal valore
del legame 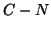 nell'isocianuro ad un valore maggiore nel prodotto
di reazione.
nell'isocianuro ad un valore maggiore nel prodotto
di reazione.
- Partendo dal sistema dell'isocianuro di metile, all'aumentare
della coordinata di reazione l'energia aumenta fino a raggiungere un
massimo. Per tale valore della coordinata di reazione, il legame
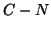 si e' parzialmente spezzato, quello
si e' parzialmente spezzato, quello 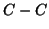 del prodotto
finale si e' parzialmente formato e il gruppo
del prodotto
finale si e' parzialmente formato e il gruppo 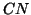 si trova a meta'
strada fra la posizione finale e quella che aveva all'inizio.
si trova a meta'
strada fra la posizione finale e quella che aveva all'inizio.
- Il sistema corrispondente al massimo del profilo di reazione si
chiama complesso attivato.




Next: Slide n. 245: figura
Up: Slides delle lezioni del
Previous: Slide n. 243: integrazione