



Next: Slide n. 234: soluti
Up: Slides delle lezioni del
Previous: Slide n. 232: figura
- La sovrapressione che si osserva in condizioni di equilibrio
viene detta pressione osmotica. Nel caso dell'esperimento in
oggetto, la pressione osmotica e' ricavabile sperimentalmente dalla
misura del dislivello
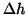 creatosi in seguito al flusso di
solvente puro nella soluzione:
creatosi in seguito al flusso di
solvente puro nella soluzione:
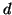 e' la densita' della soluzione all'equilibrio e puo' essere
approssimata con la densita' del solvente puro se la soluzione e'
diluita,
e' la densita' della soluzione all'equilibrio e puo' essere
approssimata con la densita' del solvente puro se la soluzione e'
diluita, 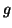 e' l'accelerazione di gravita' (
e' l'accelerazione di gravita' (
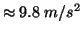 ).
).
- La pressione osmotica e' legata alla concentrazione molare del
soluto nella soluzione dalla relazione
dove 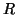 e' la costante universale dei gas,
e' la costante universale dei gas, 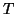 e' la temperatura
assoluta e
e' la temperatura
assoluta e 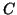 e' la concentrazione molare del soluto.
e' la concentrazione molare del soluto.
- L'osmosi ha un'importanza enorme a livello biologico, visto che
e' praticamente l'unico meccanismo con cui le sostanze possono
attraversare le membrane cellulari. Non a caso, ad esempio, la
cosiddetta ``soluzione fisiologica'' che si somministra per via
endovenosa a pazienti disidratati non e' acqua pura, ma una soluzione
di
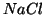 isotonica col sangue. Se si iniettasse acqua
pura, si avrebbe un flusso di acqua dal sangue nelle cellule con un
loro conseguente ingrossamento ed eventuale esplosione!
isotonica col sangue. Se si iniettasse acqua
pura, si avrebbe un flusso di acqua dal sangue nelle cellule con un
loro conseguente ingrossamento ed eventuale esplosione!
- L'osmosi e le seppie in umido.
Quando si lessano delle seppie, e' buona norma cucinarle in acqua
non salata. Infatti, vivendo in mare, la concentrazione salina nelle
cellule di questi animali e' elevata. La cozione in acqua non salata
provoca, per osmosi, un accumulo di acqua nelle cellule che porta alla
loro esplosione. La conseguenza di cio' e' che le seppie cucinate in
questo modo risultano piu' morbide.




Next: Slide n. 234: soluti
Up: Slides delle lezioni del
Previous: Slide n. 232: figura