



Next: Slide n. 229: figura
Up: Slides delle lezioni del
Previous: Slide n. 227: segue
- L'innalzamento ebullioscopico e l'abbassamento crioscopico.
Si e' visto che la presenza di un soluto non volatile provoca un
abbassamento della pressione di vapore della soluzione (rispetto alla
pressione di vapore del solvente puro) a tutte le temperature.
- Questo fatto puo' essere messo in evidenza sul diagramma di
stato del solvente puro con uno shift della curva di equilibrio
liquido-vapore verso il basso.
- Come conseguenza di tale shift, l'intersezione della retta
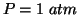 con la nuova curva di equilibrio liquido-vapore avviene
ad una temperatura piu' elevata della temperatura normale di
ebollizione del solvente puro.
con la nuova curva di equilibrio liquido-vapore avviene
ad una temperatura piu' elevata della temperatura normale di
ebollizione del solvente puro.
- Quindi, l'abbassamento della pressione di vapore provoca anche
un innalzamento della temperatura di ebollizione della soluzione,
detto innalzamento ebullioscopico. L'innalzamento
ebullioscopico e' una proprieta' colligativa ed e' dato
quantitativamente dalla relazione:
dove 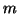 e' la molalita' del soluto e
e' la molalita' del soluto e 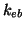 e' una costante
caratteristica del solvente detta costante ebullioscopica.
e' una costante
caratteristica del solvente detta costante ebullioscopica.
- Un'altra conseguenza dell'abbassamento della pressione di vapore
della soluzione e' che l'intersezione della retta
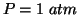 con la
curva di equilibrio solido-liquido avviene ad una temperatura piu'
bassa di quella del solvente puro. Cioe': il solvente nella soluzione
solidifica ad una temperatura inferiore a quella del solvente puro. La
differenza fra i due punti normali di solidificazione e' detta
abbassamento crioscopico ed e' data da:
con la
curva di equilibrio solido-liquido avviene ad una temperatura piu'
bassa di quella del solvente puro. Cioe': il solvente nella soluzione
solidifica ad una temperatura inferiore a quella del solvente puro. La
differenza fra i due punti normali di solidificazione e' detta
abbassamento crioscopico ed e' data da:
dove 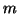 e' la molalita' del soluto e
e' la molalita' del soluto e 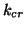 e' una costante
caratteristica del solvente detta costante crioscopica.
e' una costante
caratteristica del solvente detta costante crioscopica.




Next: Slide n. 229: figura
Up: Slides delle lezioni del
Previous: Slide n. 227: segue