



Next: Slide n. 221: regione
Up: Slides delle lezioni del
Previous: Slide n. 219: figura
- I tre rami di curva sul piano
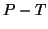 ottenuti in
questo esperimento costituiscono quello che si chiama un
diagramma di fase, cioe', per quanto visto, un diagramma che
mostra le coppie di valori di pressione e temperatura per cui si ha
equilibrio fra le diverse fasi in cui puo' esistere una sostanza.
ottenuti in
questo esperimento costituiscono quello che si chiama un
diagramma di fase, cioe', per quanto visto, un diagramma che
mostra le coppie di valori di pressione e temperatura per cui si ha
equilibrio fra le diverse fasi in cui puo' esistere una sostanza.
- (Nel caso piu' semplice) il diagramma di fase divide il piano
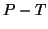 in tre zone, delimitate dai tre rami di curva discussi: ciascun
ramo rappresenta il luogo dei punti di equilibrio fra due fasi mentre
in ciascuna regione del piano
in tre zone, delimitate dai tre rami di curva discussi: ciascun
ramo rappresenta il luogo dei punti di equilibrio fra due fasi mentre
in ciascuna regione del piano 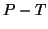 , la temperatura e la pressione
sono tali per cui solo una fase (solida, liquida o gassosa) puo'
esistere in condizioni di equilibrio.
, la temperatura e la pressione
sono tali per cui solo una fase (solida, liquida o gassosa) puo'
esistere in condizioni di equilibrio.
- La temperatura a cui si ha equilibrio solido-liquido alla
pressione di
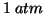 viene detta temperatura normale di
congelamento; analogamente, la temperatura a cui si ha equilibrio
liquido-vapore alla pressione di
viene detta temperatura normale di
congelamento; analogamente, la temperatura a cui si ha equilibrio
liquido-vapore alla pressione di 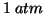 viene detta
temperatura normale di ebollizione (figura)
viene detta
temperatura normale di ebollizione (figura)
- In generale, l'ebollizione e' una transizione dalla fase liquida
a quella vapore quando la pressione di vapore del liquido e' uguale o
maggiore della pressione esterna. Mentre nell'evaporazione solo le
molecole della superficie del liquido passano in fase vapore,
nell'ebollizione, tutte le molecole del liquido (anche quelle che si
trovano al di sotto della superficie) passano in fase vapore: cio' si
manifesta con la formazione di bolle di vapore nella massa del
liquido. La formazione delle bolle e' dovuta proprio al fatto che
la pressione di vapore del liquido uguaglia la pressione esterna:
infatti, affinche' una bolla possa formarsi e crescere, bisogna che la
pressione del vapore al suo interno sia uguale alla pressione
esterna, che e' uguale a quella atmosferica (piu' il
piccolo contributo dovuto al peso del liquido soprastante).




Next: Slide n. 221: regione
Up: Slides delle lezioni del
Previous: Slide n. 219: figura