



Next: Slide n. 209: perturbazione
Up: Slides delle lezioni del
Previous: Slide n. 207: l'equilibrio
- La natura dinamica (e non statica) dell'equilibrio chimico fa si'
che un sistema chimico all'equilibrio possa reagire ad una
perturbazione raggiungendo spontaneamente un nuovo stato di
equilibrio.
- Ad esempio, supponiamo che il recipiente contenente l'acqua
liquida in equilibrio col suo vapore sia un cilindro con pistone. Cosa
succede se improvvisamente aumentiamo il volume sollevando il
pistone? (figura)
- All'equilibrio, la velocita' di condensazione era uguale a
quella di evaporazione. L'aumento di volume provoca una diminuzione
della pressione e della concentrazione nella fase vapore
(
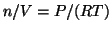 ). Cio', a sua volta, provoca una diminuzione della
velocita' di condensazione (mentre la velocita' di evaporazione non
varia, dipendendo solo dalla temperatura).
). Cio', a sua volta, provoca una diminuzione della
velocita' di condensazione (mentre la velocita' di evaporazione non
varia, dipendendo solo dalla temperatura).
- Il sistema non e' piu' all'equilibrio: nell'unita' di tempo, il
numero di molecole che condensano e' minore di quello delle molecole
che evaporano
- In tale situazione si avra' un passaggio netto di molecole dalla
fase liquida a quella vapore e la concentrazione nella fase vapore (e
la pressione) aumentera' nel tempo.
- D'altro canto, l'aumento della concentrazione nella fase
vapore provochera' un'accelerazione del processo di condensazione (la
cui velocita' e' proporzionale alla concentrazione nella fase
gassosa)
- La velocita' di condensazione (e la pressione) aumentera' nel
tempo finche' raggiungera' nuovamente il valore della velocita' di
evaporazione: a questo punto il sistema e' di nuovo all'equilibrio




Next: Slide n. 209: perturbazione
Up: Slides delle lezioni del
Previous: Slide n. 207: l'equilibrio