Next: Slide n. 203: l'equilibrio
Up: Slides delle lezioni del
Previous: Slide n. 201: forze
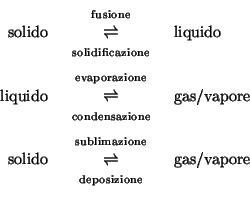
Equilibri di fase.
- Ricordiamo che una fase e' una porzione di materia omogenea in
ogni sua parte (cioe' le sue proprieta' chimiche e fisiche non
dipendono dal punto in cui vengono misurate)
- Un liquido, un gas o un solido sono delle fasi.
- Un solido riscaldato fonde e diventa liquido; un liquido
riscaldato evapora e diventa gas.
- E' possibile trasformare una fase in un altra variando la
pressione e/o la temperatura. Quando una fase viene trasformata in
un'altra si parla di transizione di fase. Le principali
transizioni di fase sono:
- Ad ogni transizione di fase e' associata una corrispondente variazione di
entalpia. Ad esempio, l'entalpia di evaporazione dell'acqua a
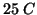 e'
e'
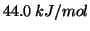 : cio' significa che per trasformare in vapore una
mole di acqua liquida alla temperatura di
: cio' significa che per trasformare in vapore una
mole di acqua liquida alla temperatura di 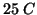 bisogna fornire
una quantita' di calore (a pressione costante) pari a
bisogna fornire
una quantita' di calore (a pressione costante) pari a 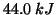 .
.
- In una transizione di fase, si parte da una data fase (ad
esempio un liquido) e, variando pressione e/o temperatura si arriva ad
un'altra fase (ad esempio un gas). Lungo questo processo esiste una
coppia di valori di pressione e temperatura per cui le due fasi
coesistono in equilibrio.




Next: Slide n. 203: l'equilibrio
Up: Slides delle lezioni del
Previous: Slide n. 201: forze