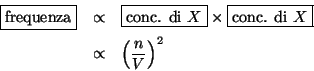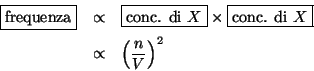Next: Slide n. 194: l'equazione
Up: Slides delle lezioni del
Previous: Slide n. 192: la
- La legge del gas ideale e' seguita con buona approssimazione da
tutti i gas a pressioni sufficientemente basse. Tuttavia, a pressioni
piu' elevate, si osservano delle deviazioni dal comportamento ideale.
- La pressione che un gas esercita sulle pareti del recipiente che
lo contiene e' dovuta agli urti delle molecole contro le pareti. A
basse pressioni, la concentrazione del gas in molecole per unita' di
volume e' bassa (
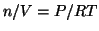 ) e quindi due molecole di gas si
incontrano raramente.
) e quindi due molecole di gas si
incontrano raramente.
- Ad alte pressioni, l'``affollamento'' e' maggiore e gli incontri
fra le molecole del gas sono piu' frequenti.
Quando due molecole si
incontrano, esercitano mutue forze di attrazione intermolecolari (che
vedremo piu' in dettaglio in seguito): cio' fa si' che per un certo
tempo, le due molecole restino associate:
La frequenza degli incontri e' proporzionale alla concentrazione dei
due partners:
- Le forze di attrazione intermolecolare diminuiscono la frequenza
degli urti contro le pareti del recipiente e quindi la pressione
esercitata dal gas risulta minore di quella ``ideale''.
- Un altro effetto provocato dalla pressione elevata di un gas e'
in relazione al volume effettivamente disponibile.
- Le molecole del gas hanno un loro volume: tale volume diventa
apprezzabile in confronto al volume del recipiente quando la densita'
del gas in molecole per unita' di volume e' elevata (e cio' si
verifica ad alte pressioni:
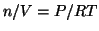 ).
).
- In tali condizioni, il volume ``geometrico'' misurabile per il
gas e' in realta' maggiore del volume effettivamente disponibile,
perche' parte del volume geometrico e' in realta' riempito dalle molecole.




Next: Slide n. 194: l'equazione
Up: Slides delle lezioni del
Previous: Slide n. 192: la