



Next: Slide n. 182: l'entalpia
Up: Slides delle lezioni del
Previous: Slide n. 180: il
- In generale, calore e lavoro non sono funzioni di
stato, cioe' pur restando fissi lo stato iniziale e quello finale, il
lavoro compiuto sul e il calore scambiato dal sistema dipendono dal
particolare percorso seguito. Il primo principio della
termodinamica afferma che, pur non essendo lavoro e calore funzioni
di stato, la loro somma e' espressa dalla variazione di una funzione di
stato. Tale funzione di stato prende il nome di energia
interna. Quindi, in base a quanto detto per le funzioni di stato in
generale, la formulazione matematica del primo principio e':
dove 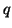 e' il calore scambiato dal sistema (e quindi sara'
positivo se viene assorbito e negativo se viene ceduto) e
e' il calore scambiato dal sistema (e quindi sara'
positivo se viene assorbito e negativo se viene ceduto) e 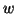 e' il
lavoro compiuto dall'ambiente sul sistema (ad esempio, per un
gas in un cilindro con pistone, si avra'
e' il
lavoro compiuto dall'ambiente sul sistema (ad esempio, per un
gas in un cilindro con pistone, si avra'
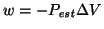 ).
).
- L'energia interna e' l'energia posseduta ``intrinsecamente'' da
un sistema termodinamico e a livello microscopico e' data dalla somma
delle energie cinetiche e potenziali di tutte le particelle che lo
costituiscono.
- In pratica, il primo principio afferma che l'energia non puo'
essere ne' creata ne' distrutta. Ad esempio, se un gas assorbe calore (
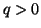 ),
si espande, cioe' compie un lavoro sull'ambiente (e quindi il lavoro
compiuto dall'ambiente sul sistema e' negativo,
),
si espande, cioe' compie un lavoro sull'ambiente (e quindi il lavoro
compiuto dall'ambiente sul sistema e' negativo, 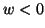 ): il primo
principio mantiene il bilancio energetico di questo processo, nel
senso che tutta l'energia assorbita sotto forma di calore e non
riapparsa come lavoro di espansione, non e' scomparsa, ma e' andata ad
incrementare l'energia interna del gas.
): il primo
principio mantiene il bilancio energetico di questo processo, nel
senso che tutta l'energia assorbita sotto forma di calore e non
riapparsa come lavoro di espansione, non e' scomparsa, ma e' andata ad
incrementare l'energia interna del gas.
- Da notare che il primo principio definisce solo la
variazione di energia interna;
l'energia interna assoluta di un sistema non
e' determinabile.




Next: Slide n. 182: l'entalpia
Up: Slides delle lezioni del
Previous: Slide n. 180: il