Applicando la procedura generale per disegnare
le formule di Lewis, la molecola di ![]() dovrebbe essere descritta
come ibrido di risonanza tra due formule limite identiche, con un legame
dovrebbe essere descritta
come ibrido di risonanza tra due formule limite identiche, con un legame
![]() singolo ed uno doppio (vedere la figura). In tale formulazione,
tuttavia, le cariche atomiche formali sullo zolfo e sull'ossigeno legato
con legame singolo sarebbero
singolo ed uno doppio (vedere la figura). In tale formulazione,
tuttavia, le cariche atomiche formali sullo zolfo e sull'ossigeno legato
con legame singolo sarebbero ![]() e
e ![]() , rispettivamente. Siccome
lo zolfo puo' dare valenza espansa, un'altra possibile descrizione della
molecola si ottiene assumendo che entrambi i legami
, rispettivamente. Siccome
lo zolfo puo' dare valenza espansa, un'altra possibile descrizione della
molecola si ottiene assumendo che entrambi i legami ![]() siano doppi:
in tal modo lo zolfo e' circondato da
siano doppi:
in tal modo lo zolfo e' circondato da ![]() , ma la carica atomica
formale su ciascuno dei tre atomi costituenti la molecola e'
nulla. Questa descrizione e' supportata dai dati sperimentali che
indicano un considerevole carattere di legame multiplo tra zolfo ed
ossigeno: si puo' pertanto considerare la molecola di
, ma la carica atomica
formale su ciascuno dei tre atomi costituenti la molecola e'
nulla. Questa descrizione e' supportata dai dati sperimentali che
indicano un considerevole carattere di legame multiplo tra zolfo ed
ossigeno: si puo' pertanto considerare la molecola di ![]() come un
ibrido di risonanza tra le due strutture citate (di cui la prima, come
detto, e' espressa a sua volta con due formule limite equivalenti):
come un
ibrido di risonanza tra le due strutture citate (di cui la prima, come
detto, e' espressa a sua volta con due formule limite equivalenti):
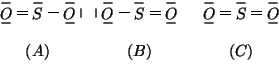
Limitandoci alla descrizione della molecola con ![]() doppi legami
(struttura
doppi legami
(struttura
![]() ), gli elettroni di valenza di ciascun
atomo risultano:
), gli elettroni di valenza di ciascun
atomo risultano:
L'atomo di ![]() e' circondato da
e' circondato da ![]() coppie strutturali e
quindi richiede un'ibridazione di tipo
coppie strutturali e
quindi richiede un'ibridazione di tipo ![]() , ottenuta combinando
l'orbitale
, ottenuta combinando
l'orbitale ![]() con
con ![]() dei
dei ![]() orbitali
orbitali ![]() . Dalla formula
di Lewis si vede che l'atomo di
. Dalla formula
di Lewis si vede che l'atomo di ![]() possiede una coppia di non
legame e deve formare
possiede una coppia di non
legame e deve formare ![]() legami
legami ![]() e
e ![]() legami
legami ![]() ;
quindi, i
;
quindi, i ![]() elettroni dello zolfo andranno sistemati come segue:
una coppia solitaria occupa uno dei
elettroni dello zolfo andranno sistemati come segue:
una coppia solitaria occupa uno dei ![]() orbitali ibridi,
orbitali ibridi, ![]() elettroni vengono sistemati, uno per orbitale, nei rimanenti
elettroni vengono sistemati, uno per orbitale, nei rimanenti ![]() orbitali ibridi. Gli ultimi
orbitali ibridi. Gli ultimi ![]() elettroni devono restare spaiati per
formare i due legami
elettroni devono restare spaiati per
formare i due legami ![]() : uno di essi occupa l'orbitale
: uno di essi occupa l'orbitale ![]() puro
perpendicolare al piano degli orbitali idridi e l'altro occupa uno dei
puro
perpendicolare al piano degli orbitali idridi e l'altro occupa uno dei
![]() orbitali
orbitali ![]() liberi, che nello zolfo, appartenente al terzo
periodo, hanno energia accessibile (questo e' il motivo per cui lo
zolfo puo' dare valenza espansa).
liberi, che nello zolfo, appartenente al terzo
periodo, hanno energia accessibile (questo e' il motivo per cui lo
zolfo puo' dare valenza espansa).