



Next: Slide n. 143: figura
Up: Slides delle lezioni del
Previous: Slide n. 141: la
Il principio della massima sovrapposizione.
- Visto che cio' che tiene uniti due atomi e' la densita' elettronica che
si viene a formare fra essi in seguito alla sovrapposizione di
orbitali atomici, e' naturale pensare che la forza di un legame sara'
tanto maggiore quanto maggiore e' la sovrapposizione fra i due orbitali
- In generale solo alcune coppie di orbitali atomici possono
sovrapporsi in modo efficace
- Gli orbitali di tipo
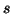 hanno simmetria sferica e quindi la
sovrapposizione fra due orbitali di tipo
hanno simmetria sferica e quindi la
sovrapposizione fra due orbitali di tipo 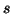 non presenta vincoli
direzionali. Es. la molecola di
non presenta vincoli
direzionali. Es. la molecola di 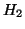
- Un orbitale
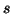 e un orbitale
e un orbitale 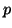 possono sovrapporsi in
modo efficace solo quando l'orbitale
possono sovrapporsi in
modo efficace solo quando l'orbitale 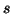 giace lungo l'asse che
contiene i due lobi dell'orbitale
giace lungo l'asse che
contiene i due lobi dell'orbitale 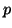
- La sovrapposizione fra due orbitali di tipo
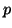 puo' avvenire in modo
efficace se i due orbitali sono disposti lungo lo stesso asse.
puo' avvenire in modo
efficace se i due orbitali sono disposti lungo lo stesso asse.
- In tutti i casi appena visti (
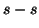 ,
, 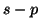 ed
ed 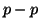 lungo lo
stesso asse), la densita' elettronica e' concentrata lungo l'asse di
legame e presenta simmetria cilindrica: si parla in questo caso di
legame
lungo lo
stesso asse), la densita' elettronica e' concentrata lungo l'asse di
legame e presenta simmetria cilindrica: si parla in questo caso di
legame 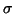
- Due orbitali
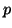 possono sovrapporsi efficacemente anche in un altro
modo, consistente nella sovrapposizione ``laterale'' dei rispettivi
lobi. In tal modo, si ha un aumento di densita' elettronica sopra e
sotto un piano contenente i due nuclei e perpendicolare all'asse degli
orbitali
possono sovrapporsi efficacemente anche in un altro
modo, consistente nella sovrapposizione ``laterale'' dei rispettivi
lobi. In tal modo, si ha un aumento di densita' elettronica sopra e
sotto un piano contenente i due nuclei e perpendicolare all'asse degli
orbitali 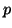 che si sono sovrapposti, mentre su tale piano la densita'
elettronica e' nulla. Si parla in questo caso di legame
che si sono sovrapposti, mentre su tale piano la densita'
elettronica e' nulla. Si parla in questo caso di legame 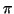 e il
piano sul quale la densita' elettronica e' nulla viene detto
piano nodale
e il
piano sul quale la densita' elettronica e' nulla viene detto
piano nodale
- Un legame di tipo
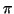 si puo' ottenere anche per
sovrapposizione di un orbitale
si puo' ottenere anche per
sovrapposizione di un orbitale 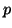 con un orbitale
con un orbitale 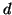 ,
opportunamente orientato
,
opportunamente orientato




Next: Slide n. 143: figura
Up: Slides delle lezioni del
Previous: Slide n. 141: la