



Next: Slide n. 139: geometria
Up: Slides delle lezioni del
Previous: Slide n. 137: carica
La teoria VSEPR per la previsione della geometria molecolare
- Le formule di Lewis servono per tenere la contabilita' degli
elettroni di valenza in semplici molecole, ma non sono in grado di dire
assolutamente nulla sulla forma delle molecole, cioe' su come gli atomi
costituenti una molecola sono disposti nello spazio.
- Una teoria in grado di prevedere la geometria di semplici molecole
e' la cosiddetta teoria VSEPR (Valence Shell Electron Pair
Repulsion). Anche questa teoria, come il metodo di Lewis, e'
estremamente semplice: cio' spiega da un lato la sua popolarita' e
utilita', dall'altro i suoi limiti.
- Anche la teoria VSEPR e' applicabile solo a molecole composte da
atomi dei blocchi
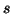 e
e 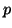 .
.
- Il concetto di base della teoria VSEPR e' il seguente:
In una molecola costituita da un atomo centrale legato ad altri atomi
terminali, le coppie elettroniche attorno all'atomo centrale (sia le
coppie di legame che quelle di non legame) tendono a respingersi e
quindi si dispongono in modo tale da rendere minima questa repulsione.
- Siccome le coppie di legame corrispondono a degli atomi legati
all'atomo centrale, il vincolo della repulsione minima determina la
disposizione nello spazio degli atomi costituenti la molecola in esame.
- Definiamo coppie strutturali l'insieme delle coppie
elettroniche di legame e non legame attorno all'atomo centrale. I legami
multipli, pur contenendo piu' di una coppia di elettroni, contano per
una sola coppia strutturale, in quanto le coppie elettroniche di un
legame multiplo sono confinate nella stessa regione di spazio e quindi,
ai fini della repulsione elettrostatica con le altre coppie, vanno prese
tutte assieme.




Next: Slide n. 139: geometria
Up: Slides delle lezioni del
Previous: Slide n. 137: carica