



Next: Slide n. 131: l'ordine
Up: Slides delle lezioni del
Previous: Slide n. 129: eccezioni
La scrittura delle formule di Lewis puo' essere ``automatizzata'' con la
seguente procedura:
- Per prevedere la disposizione degli atomi:
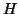 e' sempre terminale ed e' legato a un solo altro atomo
e' sempre terminale ed e' legato a un solo altro atomo
- l'atomo centrale di una molecola o di uno ione e' sempre quello a piu'
bassa affinita' elettronica
- Calcolare il numero totale di elettroni di valenza, sommando gli
elettroni di valenza di tutti gli atomi costituenti la molecola; nel
caso di ioni, il calcolo deve tenere conto della carica netta
- Cominciare ad utilizzare le coppie di elettroni di valenza per connettere
con un legame
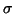 ciascun atomo terminale con l'atomo centrale
ciascun atomo terminale con l'atomo centrale
- Continuare a disporre le coppie di elettroni ancora disponibili
intorno ad ogni atomo terminale (eccetto che ad
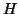 ) in numero tale da
soddisfare la regola dell'ottetto
) in numero tale da
soddisfare la regola dell'ottetto
- Se dopo l'operazione del punto precedente rimangono ancora elettroni
disponibili, disporli attorno all'atomo centrale, tenendo presente che
se questo appartiene al terzo periodo o maggiore, puo' essere
circondato da piu' di 4 coppie elettroniche (valenza espansa)
- Se a questo punto l'atomo centrale non risulta circondato da almeno 4
coppie elettroniche, trasformare uno o piu' doppietti isolati degli
atomi terminali in corrispondenti coppie di legame
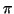 . A questo
proposito va osservato quanto segue:
. A questo
proposito va osservato quanto segue:
- generalmente, legami
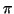 vengono formati da elementi dell'insieme
{
vengono formati da elementi dell'insieme
{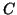 ,
,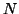 ,
,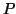 ,
,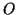 ,
,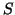 }
}
- quando per la formazione dei legami
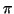 esistono piu' possibilita'
fra loro equivalenti, la molecola deve essere descritta da tutte le
corrispondenti forme di risonanza
esistono piu' possibilita'
fra loro equivalenti, la molecola deve essere descritta da tutte le
corrispondenti forme di risonanza




Next: Slide n. 131: l'ordine
Up: Slides delle lezioni del
Previous: Slide n. 129: eccezioni
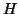 e' sempre terminale ed e' legato a un solo altro atomo
e' sempre terminale ed e' legato a un solo altro atomo
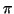 vengono formati da elementi dell'insieme
{
vengono formati da elementi dell'insieme
{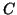 ,
,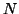 ,
,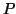 ,
,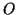 ,
,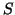 }
}
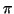 esistono piu' possibilita'
fra loro equivalenti, la molecola deve essere descritta da tutte le
corrispondenti forme di risonanza
esistono piu' possibilita'
fra loro equivalenti, la molecola deve essere descritta da tutte le
corrispondenti forme di risonanza