



Next: Slide n. 113: il
Up: Slides delle lezioni del
Previous: Slide n. 111: come
La configurazione elettronica degli atomi nello stato fondamentale
- Come abbiamo visto, l'approssimazione orbitalica consente di
descrivere ogni elettrone di un sistema polielettronico con un
orbitale del tutto simile a quelli visti per i sistemi
monoelettronici.
- Lo stato fondamentale di un atomo e' quello in cui esso ha la
minima energia. Si e' visto che l'orbitale avente la minima energia e'
l'orbitale
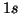 ; verrebbe quindi spontaneo di pensare che nella configurazione
elettronica dello stato fondamentale di qualsiasi atomo ogni elettrone
sia descritto da un orbitale
; verrebbe quindi spontaneo di pensare che nella configurazione
elettronica dello stato fondamentale di qualsiasi atomo ogni elettrone
sia descritto da un orbitale 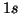 .
.
- In realta' cio' non e' possibile e la formalizzazione di questa
impossibilita' e' nota come principio di esclusione di Pauli.
- Prima di enunciare questo principio, bisogna introdurre il
concetto di spin dell'elettrone. Lo spin e' una proprieta'
esclusivamente quantomeccanica, che puo' essere (anche se solo
lontanamente) interpretata classicamente come connessa alla rotazione di
un corpo su se stesso attorno a un qualche asse. La rotazione
dell'elettrone su se stesso gli conferisce proprieta' magnetiche (cioe'
l'elettrone si comporta come un minuscolo magnete). Tali proprieta' non
vanno confuse con quelle derivanti dal suo moto angolare attorno al
nucleo, a cui e' associato il numero quantico magnetico
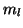 . Allo
spin elettronico e' associato un numero quantico magnetico di spin
. Allo
spin elettronico e' associato un numero quantico magnetico di spin 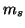 che
puo' assumere solo due valori semiinteri:
che
puo' assumere solo due valori semiinteri: 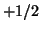 e
e 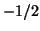 , in
corrispondenza ai due possibili versi di rotazione (orario e
antiorario). Il valore
, in
corrispondenza ai due possibili versi di rotazione (orario e
antiorario). Il valore 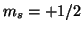 viene spesso indicato con
viene spesso indicato con
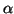 o
o 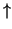 ; il valore
; il valore 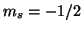 viene indicato con
viene indicato con
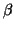 o
o 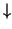 .
.




Next: Slide n. 113: il
Up: Slides delle lezioni del
Previous: Slide n. 111: come