



Next: Slide n. 108: figura
Up: Slides delle lezioni del
Previous: Slide n. 106: gli
- Gli orbitali monoelettronici che si ricavano
dall'approssimazione orbitalica sono molto simili a quelli visti per i
sistemi ad un solo elettrone e dipendono dagli stessi numeri quantici
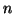 ,
, 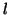 ed
ed 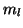 che abbiamo visto per i sistemi a un solo
elettrone.
che abbiamo visto per i sistemi a un solo
elettrone.
- Tuttavia, diversamente dagli atomi idrogenoidi, l'energia degli
orbitali non dipende solo dal numero quantico principale
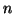 , ma
anche dal numero quantico del momento angolare
, ma
anche dal numero quantico del momento angolare 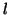 . Cioe', in un
atomo polielettronico, un elettrone descritto da un orbitale
. Cioe', in un
atomo polielettronico, un elettrone descritto da un orbitale 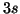 ha
energia diversa da un elettrone di tipo
ha
energia diversa da un elettrone di tipo 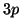
- Questa minor degenerazione dei livelli energetici negli atomi
polielettronici viene generalmente spiegata con il cosiddetto
effetto schermo. Nell'atomo idrogenoide si e' visto che la
distanza media dell'elettrone dal nucleo cresce con
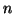 . Lo stesso
vale per gli orbitali che si ottengono con l'approssimazione
orbitalica per sistemi polielettronici. Per questo motivo la struttura di
un atomo polielettronico viene descritta in termini di
strati o gusci elettronici: gli elettroni
caratterizzati da
. Lo stesso
vale per gli orbitali che si ottengono con l'approssimazione
orbitalica per sistemi polielettronici. Per questo motivo la struttura di
un atomo polielettronico viene descritta in termini di
strati o gusci elettronici: gli elettroni
caratterizzati da 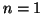 costituiscono il primo strato piu' interno,
quelli con
costituiscono il primo strato piu' interno,
quelli con 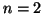 costituiscono il secondo strato, quelli con
costituiscono il secondo strato, quelli con 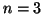 costituiscono il terzo strato e cosi' via, a seconda del numero di
elettroni dell'atomo (numero atomico). Lo strato elettronico piu'
esterno (caratterizzato dal massimo valore di
costituiscono il terzo strato e cosi' via, a seconda del numero di
elettroni dell'atomo (numero atomico). Lo strato elettronico piu'
esterno (caratterizzato dal massimo valore di 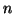 per un certo
atomo) viene detto strato di valenza
per un certo
atomo) viene detto strato di valenza
- Nell'ambito di questa rappresentazione a strati, un dato guscio
elettronico non percepisce solo l'attrazione della carica nucleare, ma
anche la repulsione dei gusci elettronici piu' interni. In
pratica, dal punto di vista del guscio elettronico considerato, e'
come se la carica nucleare fosse, per l'appunto, schermata;
l'effetto schermo fa sì che la carica nucleare effettivamente
percepita dal guscio elettronico in questione sia minore di quanto si
potrebbe prevedere sulla base del numero atomico: tale carica ridotta
viene detta carica nucleare efficace




Next: Slide n. 108: figura
Up: Slides delle lezioni del
Previous: Slide n. 106: gli