 |
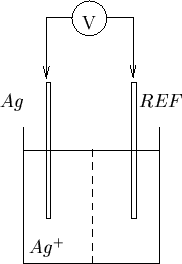
Si e' detto che le misure potenziometriche implicano una cella con (almeno) due elettrodi e che uno dei due e' (quasi sempre) un elettrodo di riferimento. L'altro elettrodo e' in genere quello il cui potenziale e' utilizzato per scopi analitici e si chiama elettrodo indicatore. Come primo esempio, consideriamo la cella schematizzata in figura 1.8.
Il filo di ![]() immerso nella soluzione contenente ioni
immerso nella soluzione contenente ioni ![]() (a
concentrazione ignota) e' l'elettrodo indicatore. Il
suo potenziale e' dato da:
(a
concentrazione ignota) e' l'elettrodo indicatore. Il
suo potenziale e' dato da:
La differenza di potenziale della cella e' data da:
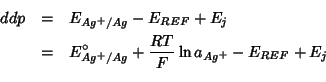
ovvero, supponendo di poter trascurare il potenziale di giunto
![]() :
:
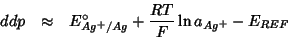
Quindi, conoscendo
![]() e
e ![]() e misurando la
differenza di potenziale, si puo' determinare l'attivita' incognita
degli ioni
e misurando la
differenza di potenziale, si puo' determinare l'attivita' incognita
degli ioni ![]() (e quindi la loro concentrazione, se e' noto il
coefficiente di attivita').
(e quindi la loro concentrazione, se e' noto il
coefficiente di attivita').
L'elettrodo indicatore visto in questo esempio risponde all'attivita'
di uno ione direttamente implicato in uno scambio elettronico nel
corso della reazione elettrodica. Elettrodi di questo tipo si dicono
di prima specie. Gli elettrodi indicatori di
seconda specie rispondono all'attivita' di ioni il cui stato
di ossidazione non cambia durante la reazione elettrodica. Un esempio
di elettrodo di seconda specie e' stato visto parlando dell'elettrodo
di riferimento ![]() , che puo' essere utilmente impiegato come
elettrodo indicatore sensibile all'attivita' degli ioni
, che puo' essere utilmente impiegato come
elettrodo indicatore sensibile all'attivita' degli ioni ![]() . Si
era infatti visto che il potenziale di questo elettrodo dipende
dall'attivita' degli ioni
. Si
era infatti visto che il potenziale di questo elettrodo dipende
dall'attivita' degli ioni ![]() secondo:
secondo:
e quindi, se ![]() e' mantenuta costante, allora
e' mantenuta costante, allora
![]() e l'elettrodo funziona da riferimento; se
invece
e l'elettrodo funziona da riferimento; se
invece ![]() non e' nota, essa puo' essere determinata da
una misura di
non e' nota, essa puo' essere determinata da
una misura di ![]() , e in questo caso lo stesso elettrodo viene usato
come indicatore.
, e in questo caso lo stesso elettrodo viene usato
come indicatore.
Il fatto che un elettrodo possa rispondere all'attivita' di una specie
che non scambia elettroni puo' forse creare qualche perplessita'. Nel
caso dell'elettrodo ad ![]() sembrerebbe logico che il potenziale
dipenda dall'attivita' degli ioni
sembrerebbe logico che il potenziale
dipenda dall'attivita' degli ioni ![]() piuttosto che da quella
degli ioni
piuttosto che da quella
degli ioni ![]() . In effetti, la concentrazione di queste due
specie ioniche e' legata (in presenza di
. In effetti, la concentrazione di queste due
specie ioniche e' legata (in presenza di ![]() ) dalla
relazione:
) dalla
relazione:
Cio' fa si' che il potenziale dell'elettrodo possa essere espresso indifferentemente in termini dell'attivita' di una qualsiasi delle due specie ioniche:
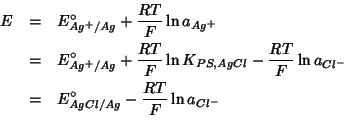
avendo definito:
Per quanto riguarda le realizzazioni commerciali di elettrodi indicatori, vale la pena di illustrare brevemente i cosiddetti elettrodi combinati. Si tratta di sistemi estremamente compatti che contengono l'elettrodo indicatore vero e proprio insieme all'elettrodo di riferimento in un unico stilo. Immergendo tale assemblaggio nella soluzione test si realizza una cella elettrochimica completa, come quella mostrata, ad esempio, in figura 1.8. La corrispondenza fra lo schema di principio e la realizzazione pratica di un elettrodo combinato e' illustrata in figura 1.9.
Quelli appena visti rappresentano esempi di potenziometria diretta, in cui, cioe', la concentrazione di una specie viene determinata tramite una singola misura di differenza di potenziale. La tecnica della potenziometria diretta viene distinta da quella della titolazione potenziometrica. Quest'ultima, come si puo' facilmente comprendere, e' una tecnica di titolazione ordinaria in cui la misura di differenza di potenziale serve per monitorare il corso della titolazione: riportando in grafico la ddp misurata in funzione del volume di titolante aggiunto si ottiene la caratteristica curva sigmoide da cui si ricava il punto finale. E' chiaro che in questo caso si e' interessati alle variazioni (piuttosto che ai valori assoluti) della differenza di potenziale e questo presenta dei vantaggi. Ad esempio, non serve conoscere il potenziale del riferimento usato (se diverso dall'SHE). Non e' richiesta neppure la conoscenza dei potenziali di giunto eventualmente presenti (e' richiesto pero' che essi rimangano costanti durante la misura).