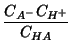 |
(A.2) | ||
| (A.3) | |||
| (A.4) | |||
| (A.5) |
Il sistema e' completamente descritto dalle seguenti equazioni:
L'equazione (A.2) e' l'espressione della legge dell'azione di massa per l'equilibrio di dissociazione dell'acido debole; l'equazione (A.3) e' l'espressione della legge dell'azione di massa per l'equilibrio di autoionizzazione dell'acqua; l'equazione (A.4) esprime la condizione di elettroneutralita' della soluzione; l'equazione (A.5) esprime la condizione di conservazione della quantita' totale di anione dell'acido debole.
![]() e
e ![]() dipendono da
dipendono da ![]() . Infatti, dalla
(A.1):
. Infatti, dalla
(A.1):
e quindi:
Il sistema puo' quindi essere riscritto nella forma:
A questo punto, per ogni valore di ![]() , il sistema puo' essere
risolto (assegnati i valori ai parametri) per via numerica, ottenendo
il valore delle quattro concentrazioni incognite.
, il sistema puo' essere
risolto (assegnati i valori ai parametri) per via numerica, ottenendo
il valore delle quattro concentrazioni incognite.
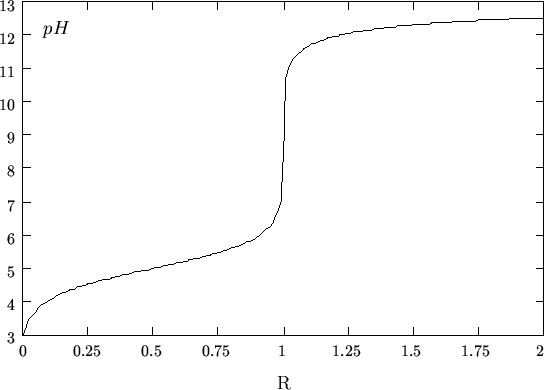
Un esempio di calcolo e' mostrato nella figura A.1.
 |