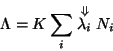
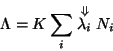
La conducibilita' ionica individuale di un certo ione indica la sua capacita' di muoversi in soluzione sotto l'effetto di un campo elettrico.
La conducibilita' ionica individuale varia leggermente con la
diluizione: per questo si trovano tabulati i valori di
![]() , conducibilita' ionica individuale a diluizione
infinita.
, conducibilita' ionica individuale a diluizione
infinita.
| Cationi |
|
Anioni |
|
|
|
|
||
| 350 | 198.6 | ||
| 77.5 |
|
110.5 | |
| 76.8 |
|
101.0 | |
| 73.5 | 80 | ||
| 73.5 | 78.1 | ||
| 70.0 | 76.8 | ||
| 69.5 | 76.3 | ||
| 63.6 | 71.4 | ||
| 63.0 | 69.3 | ||
| 61.9 | 67.3 | ||
| 59 | 55.7 | ||
| 55 | 55.4 | ||
| 53.6 | 54.5 | ||
| 54.0 | 40 9 | ||
| 53.1 | 40.5 | ||
| 53.1 | 40.2 | ||
|
|
51.8 | butirrato | 32.6 |
| 50.1 | 32.4 | ||
|
|
47.2 | picrato | 30.4 |
Moltissimi ioni hanno conducibilita' ioniche individuali molto simili poiche', a causa dell'idratazione, si ha un livellamento delle dimensioni ioniche ``effettive'' e quindi della mobilita' ionica.