



Next: Slide n. 434: esempio
Up: Slides delle lezioni del
Previous: Slide n. 432: segue
- Possiamo generalizzare quanto appena visto. L'elettrolisi e' il
processo attraverso il quale si spende energia per far avvenire una
reazione redox che spontaneamente non avverrebbe.
- In una cella elettrochimica, il verso spontaneo in cui si
muovono gli elettroni nel circuito esterno che connette le due
semicelle e' diretto dalla semicella a potenziale elettrodico minore
alla semicella a potenziale elettrodico maggiore.
- Questo verso spontaneo puo' essere invertito se le due
semicelle vengono connesse esternamente non con un semplice conduttore
elettrico, ma con un generatore di differenza di
potenziale.
- La differenza di potenziale generata dal dispositivo deve essere
tale da forzare gli elettroni a muoversi dalla semicella a potenziale
elettrodico maggiore alla semicella a potenziale elettrodico minore:
quindi il connettore
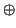 del generatore deve essere collegato
al metallo della semicella a potenziale elettrodico maggiore.
del generatore deve essere collegato
al metallo della semicella a potenziale elettrodico maggiore.
- Inoltre, affinche' gli elettroni si muovano effettivamente nella
direzione voluta, il modulo della differenza di potenziale generata
deve essere maggiore di quello della differenza fra i potenziali
elettrodici delle semicelle.
- In modo analogo a quanto visto per le pile, il flusso di
elettroni perturba le semireazioni che avvengono nelle semicelle. In
particolare, la semireazione che avviene nella semicella a potenziale
minore viene forzata nel verso della riduzione, mentre quella che
avviene nella semicella a potenziale maggiore viene forzata nel verso
dell'ossidazione.
- Il risultato globale e' quello di far avvenire la reazione redox
somma delle due semireazioni nel verso non spontaneo, cioe'
opposto a quello in cui avverrebbe se la cella elettrochimica venisse
fatta funzionare come una pila.




Next: Slide n. 434: esempio
Up: Slides delle lezioni del
Previous: Slide n. 432: segue