



Next: Slide n. 399: il
Up: Slides delle lezioni del
Previous: Slide n. 397: figura
- Vale la pena di osservare a questo punto che i due processi che
stiamo considerando sono uno l'inverso dell'altro e rappresentano
quella che e' stata definita in precedenza una
semireazione. Nel caso specifico, la semireazione riguarda la
coppia redox
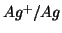 :
:
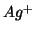 e' la forma ossidata e
e' la forma ossidata e 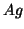 e' la forma ridotta della
coppia redox.
e' la forma ridotta della
coppia redox.
- Come avevamo preannunciato, le semireazioni non sono solo un
modo per bilanciare le reazioni redox, ma possono fisicamente
avvenire.
- In un sistema elettrodico, dunque, si puo' individuare una
coppia redox che reagisce secondo la pertinente semireazione. Questa
avviene sia nel verso della riduzione che in quello dell'ossidazione.
- Piu' sopra si e' visto che la semireazione di riduzione
tende a caricare positivamente il metallo rispetto alla
soluzione mentre la semireazione di ossidazione tende a
caricare negativamente il metallo rispetto alla soluzione.
- Come in qualsiasi altro tipo di reazione chimica, anche in
questo caso il sistema raggiunge uno stato di equilibrio dinamico,
determinato dall'uguaglianza della velocita' del processo di riduzione
e di quello inverso di ossidazione.
- La differenza di potenziale fra metallo e soluzione (cioe' il
potenziale elettrodico) che si ottiene all'equilibrio dipende da quanto
l'equilibrio e' spostato a destra o a sinistra.
- Se la riduzione ha maggior tendenza ad avvenire
dell'ossidazione, il potenziale elettrodico all'equilibrio sara'
positivo e il suo valore sara' tanto maggiore quanto maggiore e' la
tendenza ad avvenire della riduzione rispetto all'ossidazione.
- Viceversa, se la reazione di ossidazione avviene di preferenza
rispetto a quella di riduzione, si avra' un potenziale elettrodico di
equilibrio negativo; tanto piu' negativo quanto piu' l'ossidazione e'
favorita rispetto alla riduzione.




Next: Slide n. 399: il
Up: Slides delle lezioni del
Previous: Slide n. 397: figura