Esempio 61
Si trova sperimentalmente che la legge cinetica per la reazione:
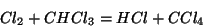
e':
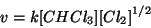
Appare subito evidente che la reazione deve essere multistadio, altrimenti la legge cinetica sarebbe del primo ordine rispetto ad entrambi i reagenti.
Un meccanismo in accordo con la legge cinetica sperimentale e' il seguente:
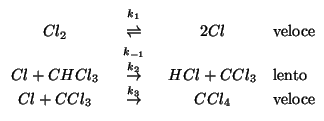 Siccome lo stadio determinante e' il secondo, la velocita' della
reazione si puo' scrivere come:
Siccome lo stadio determinante e' il secondo, la velocita' della
reazione si puo' scrivere come:
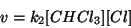
Tuttavia, la legge cinetica sperimentale viene ricavata in funzione della concentrazione dei reagenti e non contiene la concentrazione di eventuali intermedi. Per esprimere la concentrazione dell'intermedio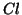 in funzione di quella dei reagenti, osserviamo
che, essendo il primo stadio veloce, esso avra' il tempo di
raggiungere l'equilibrio. Anticipando un argomento che tratteremo piu'
in dettaglio, ma ricordando cio' che e' gia' stato detto a proposito
dell'equilibrio liquido-vapore, l'equilibrio del primo stadio e'
determinato dall'uguaglianza della velocita' della reazione diretta e
di quella della reazione inversa:
in funzione di quella dei reagenti, osserviamo
che, essendo il primo stadio veloce, esso avra' il tempo di
raggiungere l'equilibrio. Anticipando un argomento che tratteremo piu'
in dettaglio, ma ricordando cio' che e' gia' stato detto a proposito
dell'equilibrio liquido-vapore, l'equilibrio del primo stadio e'
determinato dall'uguaglianza della velocita' della reazione diretta e
di quella della reazione inversa:
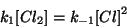
da cui:
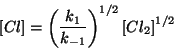
e':
Appare subito evidente che la reazione deve essere multistadio, altrimenti la legge cinetica sarebbe del primo ordine rispetto ad entrambi i reagenti.
Un meccanismo in accordo con la legge cinetica sperimentale e' il seguente:
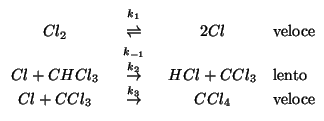
Tuttavia, la legge cinetica sperimentale viene ricavata in funzione della concentrazione dei reagenti e non contiene la concentrazione di eventuali intermedi. Per esprimere la concentrazione dell'intermedio
da cui: