procede secondo il seguente meccanismo a due stadi:
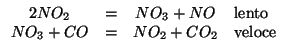
Questo esempio illustra il motivo per cui, in generale, non c'e' relazione tra coefficienti stechiometrici e ordini di reazione: siccome la reazione avviene in due stadi di cui il primo e' quello determinante e siccome