



Next: Slide n. 206: figura
Up: Slides delle lezioni del
Previous: Slide n. 204: la
- Per questo motivo, alcune delle molecole alla superficie del
liquido hanno energia sufficiente per sfuggire alle forze di
attrazione intermolecolari e passare cosi' nella fase vapore.
- Il numero di molecole che evaporano per unita' di tempo
rappresenta la velocita' di evaporazione: tale velocita' dipende dalla
temperatura ed e' costante a temperatura costante.
- Se il processo di evaporazione fosse l'unico ad avvenire, tutta
l'acqua liquida posta nel recipiente evaporerebbe
- Tuttavia, le molecole passate in fase vapore possono essere
catturate nuovamente dal campo di potenziale delle molecole in fase
liquida: la probabilita' che cio' avvenga e' proporzionale alla
concentrazione di molecole nella fase gassosa e quindi alla pressione,
dato che
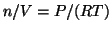 e
e
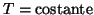
- Quindi, man mano che l'acqua evapora, la pressione della fase
gassosa aumenta e cosi' pure la velocita' di condensazione.
- Si raggiunge necessariamente la situazione in cui la velocita'
di condensazione eguaglia quella di evaporazione (figura).
- In tale situazione, nell'unita' di tempo, il numero di molecole
che evaporano e' uguale a quello delle molecole che condensano: ne
segue che il numero di molecole in fase gassosa rimane costante nel
tempo e quindi la pressione non varia ulteriormente (
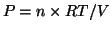 )
)
- Questo e' lo stato di equilibrio che si osserva
macroscopicamente.
- La descrizione molecolare dell'equilibrio liquido-vapore
illustra un concetto fondamentale della chimica: l'equilibrio
dinamico.




Next: Slide n. 206: figura
Up: Slides delle lezioni del
Previous: Slide n. 204: la