Next: Slide n. 187: esempi
Up: Slides delle lezioni del
Previous: Slide n. 185: l'entalpia
- La legge di Hess.
Siccome l'entalpia e' una funzione di stato, la sua variazione per una
reazione dipende solo dallo stato iniziale e da quello finale. Questo
significa che se una reazione e' data dalla somma di piu' reazioni
``parziali'', la variazione di entalpia per la reazione globale e' la
somma delle variazioni di entalpia per ogni singola reazione
componente.
Esempio 55
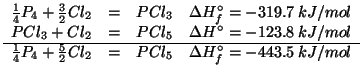
- La legge di Hess e' utile per calcolare la variazione di
entalpia per una reazione se si puo' scomporla in una serie di
reazioni la cui variazione di entalpia sia nota.
- Inoltre, sempre come conseguenza della legge di Hess, la
variazione di entalpia per una reazione qualsiasi puo' sempre essere
scritta in termini delle entalpie di formazione dei reagenti e dei
prodotti:
- Per ottenere questa relazione, e' sufficiente scrivere la
reazione in esame come somma delle reazioni di formazione di ciascun
partecipante. Le reazioni di formazione relative ai reagenti vanno
scritte in senso inverso (e quindi la variazione di entalpia ad esse
relativa va cambiata di segno). Ciascuna reazione di formazione va
inoltre moltiplicata per un opportuno fattore, in modo che i
coefficienti stechiometrici che si ottengono per la reazione
complessiva siano corretti.




Next: Slide n. 187: esempi
Up: Slides delle lezioni del
Previous: Slide n. 185: l'entalpia